Page 117 - 442
P. 117
за часом, оскільки концентрації речовин у хімічному процесі
змінюються безперервно.
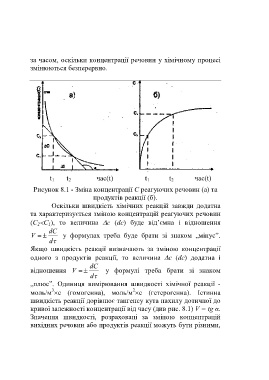
t 1 t 2 час(t) t 1 t 2 час(t)
Рисунок 8.1 - Зміна концентрації С реагуючих речовин (а) та
продуктів реакції (б).
Оскільки швидкість хімічних реакцій завжди додатна
та характеризується зміною концентрацій реагуючих речовин
(С 2С 1), то величина с (dc) буде від’ємна і відношення
dC
V у формулах треба буде брати зі знаком „мінус”.
d
Якщо швидкість реакції визначають за зміною концентрації
одного з продуктів реакції, то величина с (dc) додатна і
dC
відношення V у формулі треба брати зі знаком
d
„плюс”. Одиниця вимірювання швидкості хімічної реакції -
3
2
моль/м с (гомогенна), моль/м с (гетерогенна). Істинна
швидкість реакції дорівнює тангенсу кута нахилу дотичної до
кривої залежності концентрації від часу (див рис. 8.1) V = tg α.
Значення швидкості, розраховані за зміною концентрацій
вихідних речовин або продуктів реакції можуть бути різними,