Page 17 - 87
P. 17
16
Визначення карбонатної твердості води проводять титруванням певного
об'єму води стандартним розчином хлоридної кислоти. При цьому відбувається
взаємодія:
Ca(HCO 3) 2 + 2HCl = CaCl 2 + 2CO 2 + 2H 2O.
1.4 Методика виконання аналізу
3
Мірну колбу на 100см сполоскують двічі водою, яку беруть для аналізу, і
заповнюють її до мітки. Краплі вище мітки відбирають скрученою стрічкою
фільтрувального паперу. Відміряну воду кількісно (повністю) переносять у
конічну колбу для титрування, додають 2-3 краплі метилоранжу, добре
перемішують і відтитровують стандартним розчином хлоридної кислоти до
появи оранжевого забарвлення. Знаходять об'єм кислоти, витраченої на
титрування. Як результат аналізу приймають середнє арифметичне значення
трьох визначень. Кількість еквівалентів витраченої на титрування кислоти
(ммоль) дорівнює кількості еквівалентів солей, що обумовлюють карбонатну
твердість (ммоль). За одиницю карбонатної твердості води прийнято 1 ммоль
солей магнію, кальцію та феруму, що містяться в 1л води.
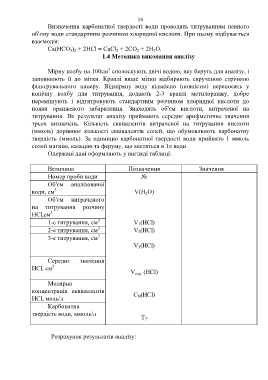
Одержані дані оформляють у вигляді таблиці:
Величина Позначення Значення
Номер проби води №
Об'єм аналізованої
3
води, см V(H 2O)
Об'єм витраченого
на титрування розчину
3
HCl,см
3
1-е титрування, см V 1(HCl)
3
2-е титрування, см V 2(HCl)
3
3-е титрування, см
V 3(HCl)
Середнє значення
HCl, см 3
V сер. (HCl)
Молярна
концентрація еквівалентів
C N(HCl)
HCl, моль/л
Карбонатна
твердість води, ммоль/л
Т Т
Розрахунок результатів аналізу: