Page 95 - 130
P. 95
95
неоднорідна і що адсорбція на кожному із типів активних центрів
підпорядковується рівнянню Ленгмюра. Крім того, Фрейндліх припускав, що
між адсорбованими молекулами існує взаємодія.
Сталі K і K коливаються в широких межах. Їх фізичний зміст стає
1
2
зрозумілим, якщо прийняти p 1 або c 1, тоді K і K являють собою
1
2
3
величину адсорбції при рівноважних тиску 1 Па або концентрації 1 моль/дм .
n
Показники 1 і 1 m є правильними дробами і характеризують ступінь
наближення ізотерми до прямої, тому з підвищенням температури сталі K і
1
K повинні зменшуватися, а 1 і 1 m збільшуватися. При n 1 і m 1
n
2
рівняння Фрейндліха перетворюється в рівняння Генрі. Горизонтальна
прямолінійна ділянка ізотерми, що відповідає високим тискам або
концентраціям ( A max в рівнянні Ленгмюра), може бути одержана тільки при
1 n 0 і 1 m 0. Таким чином, показники n1 і m1 по суті повинні бути самі
функціями тиску чи концентрації. А оскільки n1 і m1 приймаються сталими в
межах 0,2–1,0 для адсорбції із газового середовища і 1 m може приймати
значення 0,1–0,5 для адсорбції із розчинів, рівняння Фрейндліха придатне
тільки для інтервалу середніх тисків або концентрацій.
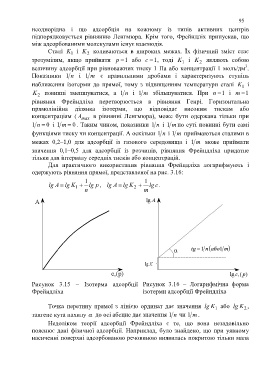
Для практичного використання рівняння Фрейндліха логарифмують і
одержують рівняння прямої, представленої на рис. 3.16:
1 1
lg A lg K lg p , lg A lg K lg c.
1
2
n m
Рисунок 3.15 − Ізотерма адсорбції Рисунок 3.16 − Логарифмічна форма
Фрейндліха ізотерми адсорбції Фрейндліха
Точка перетину прямої з лінією ординат дає значення lg K або lg K ,
1
2
тангенс кута нахилу до осі абсцис дає значення n1 чи m1 .
Недоліком теорії адсорбції Фрейндліха є те, що вона незадовільно
пояснює дані фізичної адсорбції. Наприклад, було знайдено, що при уявному
насиченні поверхні адсорбованою речовиною виявилась покритою тільки мала