Page 54 - 4663
P. 54
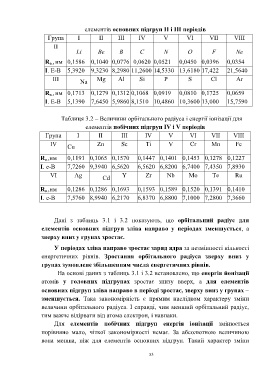
елементів основних підгруп ІІ і ІІІ періодів
Група І ІІ ІІІ ІV V VІ VІІ VІІІ
ІІ
Li Be B C N O F Ne
R о., нм 0,1586 0,1040 0,0776 0,0620 0,0521 0,0450 0,0396 0,0354
І. Е-В 5,3920 9,3230 8,2980 11,2600 14,5330 13,6180 17,422 21,5640
ІІІ Mg Al Si P S Cl Ar
Na
R о., нм 0,1713 0,1279 0,1312 0,1068 0,0919 0,0810 0,1725 0,0659
І. Е-В 5,1390 7,6450 5,9860 8,1510 10,4860 10,3600 13,000 15,7590
Таблиця 3.2 – Величини орбітального радіуса і енергії іонізації для
елементів побічних підгруп ІV і V періодів
Група І ІІ ІІІ ІV V VІ VІІ VІІІ
ІV Zn Sс Ti V Cr Mn Fe
Cu
R о.,нм 0,1191 0,1065 0,1570 0,1447 0,1401 0,1453 0,1278 0,1227
І. е-В 7,7260 9,3940 6,5620 6,5620 6,8200 6,7400 7,4350 7,8930
VІ Ag Y Zr Nb Mo Te Ru
Cd
R о.,нм 0,1286 0,1286 0,1693 0,1593 0,1589 0,1520 0,1391 0,1410
І. е-В 7,5760 8,9940 6,2170 6,8370 6,8800 7,1000 7,2800 7,3660
Дані з таблиць 3.1 і 3.2 показують, що орбітальний радіус для
елементів основних підгруп зліва направо у періодах зменшується, а
зверху вниз у групах зростає.
У періодах зліва направо зростає заряд ядра за незмінності кількості
енергетичних рівнів. Зростання орбітального радіуса зверху вниз у
групах зумовлене збільшенням числа енергетичних рівнів.
На основі даних з таблиць 3.1 і 3.2 встановлено, що енергія йонізації
атомів у головних підгрупах зростає знизу вверх, а для елементів
основних підгруп зліва направо в періоді зростає, зверху вниз у групах
зменшується. Така закономірність є прямим наслідком характеру зміни
величини орбітального радіуса. І справді, чим менший орбітальний радіус,
тим важче відірвати від атома електрон, і навпаки.
Для елементів побічних підгруп енергія іонізації змінюється
порівняно мало, чіткої закономірності немає. За абсолютною величиною
вона менша, ніж для елементів основних підгруп. Такий характер зміни
53