Page 194 - 4489
P. 194
що відповідає вмісту в 1 л води 20,04 мг іонів кальцію чи 12,16 мг іонів
магнію.
2
Збільшення витрати, % 5 2 1
2
0
1
5
1
0
5
4
1 2 3 4 5 6
Товщина шару накипу, мм
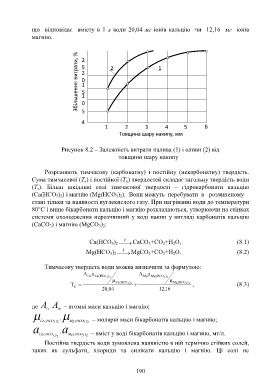
Рисунок 8.2 – Залежність витрати палива (1) і оливи (2) від
товщини шару накипу
Розрізняють тимчасову (карбонатну) і постійну (некарбонатну) твердість.
Сума тимчасової (Т к) і постійної (Т н) твердостей складає загальну твердість води
(Т з). Більш шкідливі солі тимчасової твердості – гідрокарбонати кальцію
(Са(НСО 3) 2) і магнію (Мg(НСО 3) 2). Вони можуть перебувати в розчиненому
стані тільки за наявності вуглекислого газу. При нагріванні води до температури
80°С і вище бікарбонати кальцію і магнію розкладаються, утворюючи на стінках
системи охолодження нерозчинний у воді накип у вигляді карбонатів кальцію
(СаСО 3) і магнію (MgCО 3) 2:
t
Са(НСО 3) 2 СаСО 3+СО 2+Н 2О, (8.1)
t
Mg(НСО 3) 2 MgСО 3+СО 2+Н 2О. (8.2)
Тимчасову твердість води можна визначити за формулою:
A a A a
Ca Ca ( HCO 3 2 ) Mg Mg ( HCO 3 2 )
T Ca ( HCO 3 2 ) Mg ( HCO 3 2 ) , (8.3)
K
20 , 04 12 , 16
де А , А – атомні маси кальцію і магнію;
Ca Mg
,
Ca ( HCO 3 2 ) Mg (HCO 3 2 ) – молярні маси бікарбонатів кальцію і магнію;
a ,a
Ca ( HCO ) Mg ( HCO 3 2 ) – вміст у воді бікарбонатів кальцію і магнію, мг/л.
3 2
Постійна твердість води зумовлена наявністю в ній термічно стійких солей,
таких як сульфати, хлориди та силікати кальцію і магнію. Ці солі не
190