Page 153 - 6375
P. 153
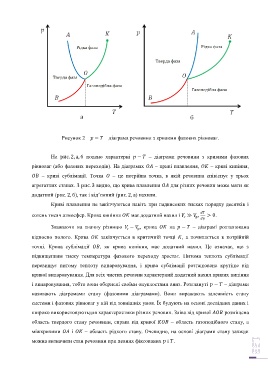
Рисунок 2 – − – діаграма речовини з кривими фазових рівноваг.
На рис. 2, а, б подано характерні − – діаграми речовини з кривими фазових
рівноваг (або фазових переходів). На діаграмах – криві плавлення, – криві кипіння,
– криві сублімації. Точка – це потрійна точка, в якій речовина співіснує у трьох
агрегатних станах. З рис. 3 видно, що крива плавлення для різних речовин може мати як
додатний (рис. 2, б), так і від’ємний (рис. 2, а) нахили.
Криві плавлення не закінчуються навіть при надвисоких тисках порядку десятків і
сотень тисяч атмосфер. Крива кипіння має додатний нахил і ≫ , > 0.
г
р
Зважаючи на значну різницю − , крива на − – діаграмі розташована
г
р
відносно полого. Крива закінчується в критичній точці , а починається в потрійній
точці. Крива сублімації , як крива кипіння, має додатний нахил. Це означає, що з
підвищенням тиску температура фазового переходу зростає. Питома теплота сублімації
перевищує питому теплоту випаровування, і крива сублімації розташована крутіше від
кривої випаровування. Для всіх чистих речовин характерний додатний нахил кривих кипіння
і випаровування, тобто вони обернені своїми опуклостями вниз. Розглянуті − – діаграми
називають діаграмами стану (фазовими діаграмами). Вони виражають залежність стану
системи і фазових рівноваг у ній від зовнішніх умов. Їх будують на основі дослідних даних і
широко використовуютьдля характеристики різних речовин. Зліва від кривої розміщена
область твердого стану речовини, справа від кривої – область газоподібного стану, а
міжкривими і – область рідкого стану. Очевидно, на основі діаграми стану завжди
можна визначити стан речовини при певних фіксованих і .