Page 102 - 130
P. 102
102
В останньому випадку це пояснюється тим, що хемосорбція є хімічним
процесом, який звичайно вимагає значної енергії активації (40-120 кДжд/моль).
Саме тому хемосорбція, як правило, є активованою адсорбцією.
Оскільки хімічну адсорбцію зумовлюють хімічні сили, десорбція протікає
важко і майже завжди замість адсорбованої речовини десорбується інша. По-
суті, десорбція здійснюється тут не за рахунок видалення молекули з поверхні
адсорбента, а в результаті розкладу утвореної при хемосорбції поверхневої
сполуки. Хемосорбція, як і хімічна реакція, є специфічною, тобто з
адсорбентом можуть взаємодіяти тільки певні адсорбтиви. Суттєвим є те, що
енергія активації зростає з підвищенням ступеня покриття поверхні адсорбента
хемосорбованими молекулами. Це можна пояснити лише існуванням активних
центрів з різними енергіями активації.
Хемосорбція нерідко протікає досить повільно зі швидкістю, що
визначається наявністю певного активаційного бар’єру. Фактично процес
хемосорбції може складатися з двох стадій. Спочатку відбувається фізична
адсорбція газу, а потім він вступає в повільну хімічну реакцію з поверхнею
твердого тіла. При низьких температурах швидкість хемосорбції може бути
такою малою, що практично спостерігається лише фізична адсорбція. При
високих температурах фізична адсорбція є майже непомітною (внаслідок
низької енергії адсорбції) і відбувається лише хемосорбція.
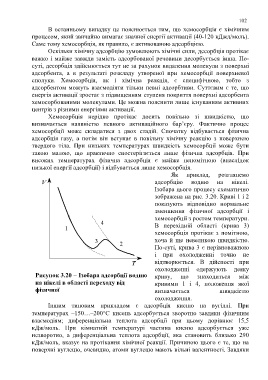
Як приклад, розглянемо
адсорбцію водню на нікелі.
Ізобара цього процесу схематично
зображена на рис. 3.20. Криві 1 і 2
показують відповідно нормальне
зменшення фізичної адсорбції і
хемосорбції з ростом температури.
В перехідній області (крива 3)
хемосорбція протікає з помітною,
хоча й ще невеликою швидкістю.
По-суті, крива 3 є нерівноважною
і при охолодженні точно не
відтворюється. В дійсності при
охолодженні одержують деяку
Рисунок 3.20 − Ізобара адсорбції водню криву, що знаходиться між
на нікелі в області переходу від кривими 1 і 4, положення якої
фізичної визначається швидкістю
адсорбції до хемосорбції охолодження.
Іншим типовим прикладом є адсорбція кисню на вугіллі. При
температурах –150…–200С кисень адсорбується зворотно завдяки фізичним
взаємодіям; диференціальна теплота адсорбції при цьому дорівнює 15,5
кДж/моль. При кімнатній температурі частина кисню адсорбується уже
незворотно, а диференціальна теплота адсорбції, яка становить близько 290
кДж/моль, вказує на протікання хімічної реакції. Причиною цього є те, що на
поверхні вуглецю, очевидно, атоми вуглецю мають вільні валентності. Завдяки