Page 39 - 4932
P. 39
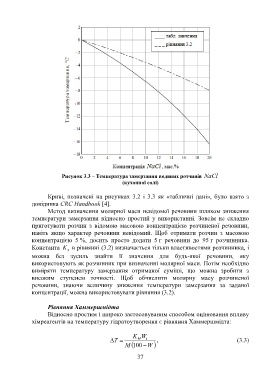
Рисунок 3.3 – Температура замерзання водяних розчинів NaCl
(кухонної солі)
Криві, позначені на рисунках 3.2 і 3.3 як «табличні дані», було взято з
довідника CRC Handbook [4].
Метод визначення молярної маси невідомої речовини шляхом зниження
температури замерзання відносно простий у використанні. Зовсім не складно
приготувати розчин з відомою масовою концентрацією розчиненої речовини,
навіть якщо характер речовини невідомий. Щоб отримати розчин з масовою
концентрацією 5 %, досить просто додати 5 г речовини до 95 г розчинника.
Константа K в рівнянні (3.2) визначається тільки властивостями розчинника, і
s
можна без зусиль знайти її значення для будь-якої речовини, яку
використовують як розчинник при визначенні молярної маси. Потім необхідно
виміряти температуру замерзання отриманої суміші, що можна зробити з
високим ступенем точності. Щоб обчислити молярну масу розчиненої
речовини, знаючи величину зниження температури замерзання за заданої
концентрації, можна використовувати рівняння (3.2).
Рівняння Хаммершмідта
Відносно простим і широко застосовуваним способом оцінювання впливу
хімреагентів на температуру гідратоутворення є рівняння Хаммершмідта:
K W
T H i , (3.3)
M 100 W
37