Page 37 - 4932
P. 37
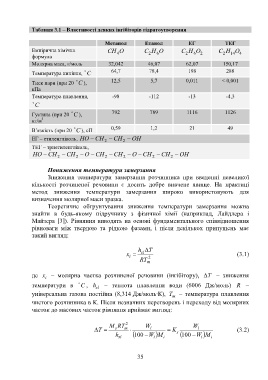
Таблиця 3.1 – Властивості деяких інгібіторів гідратоутворення
Метанол Етанол ЕГ ТЕГ
Емпірична хімічна CH 4 O C 2 H 6 O C 2 H 6 O C 2 H 14 O
4
2
формула
Молярна маса, г/моль 32,042 46,07 62,07 150,17
64,7 78,4 198 288
Температура кипіння, C
12,5 5,7 0,011 < 0,001
Тиск пари (при 20 C ),
кПа
Температура плавлення, -98 -112 -13 -4,3
C
792 789 1116 1126
Густина (при 20 C ),
кг/м 3
0,59 1,2 21 49
В’язкість (при 20 C ), сП
ЕГ – етиленгліколь, HO CH CH OH
2 2
ТЕГ – триетиленгліколь,
HO CH CH O CH CH O CH CH OH
2 2 2 2 2 2
Пониження температури замерзання
Зниження температури замерзання розчинника при введенні невеликої
кількості розчиненої речовини є досить добре вивчене явище. На практиці
метод зниження температури замерзання широко використовують для
визначення молярної маси зразка.
Теоретичне обгрунтування зниження температури замерзання можна
знайти в будь-якому підручнику з фізичної хімії (наприклад, Лайдлера і
Майзера [3]). Рівняння виводять на основі фундаментального співвідношення
рівноваги між твердою та рідкою фазами, і після декількох припущень має
такий вигляд:
h T
x sl (3.1)
i 2
RT m
де x – молярна частка розчиненої речовини (інгібітору), – зниження
T
i
температури в C , h – теплота плавлення води (6006 Дж/моль) R –
sl
універсальна газова постійна (8,314 Дж/моль·К), T – температура плавлення
m
чистого розчинника в К. Після незначних перетворень і переходу від молярних
часток до масових часток рівняння приймає вигляд:
2
M RT W W
T s m i K i (3.2)
h sl 100 W i M i s 100 W i M i
35