Page 38 - 4932
P. 38
де M – молярна маса розчинника, W – масова концентрація розчиненої
s
i
речовини (інгібітора) у %, а M – молярна маса інгібітору. Для води K s 1861,
i
якщо в рівнянні використовуються одиниці системи СІ. Головний член у
рівнянні включає в себе тільки константи, таким чином, зниження температури
замерзання є функцією концентрації інгібітору та його молярної маси.
Необхідно відзначити, що дане рівняння не застосовують для іонних розчинів,
наприклад кухонної солі. Це буде показано далі в цьому розділі.
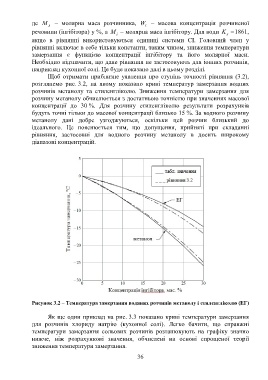
Щоб отримати приблизне уявлення про ступінь точності рівняння (3.2),
розглянемо рис. 3.2, на якому показано криві температур замерзання водних
розчинів метанолу та етиленгліколю. Зниження температури замерзання для
розчину метанолу обчислюється з достатньою точністю при значеннях масової
концентрації до 30 %. Для розчину етиленгліколю результати розрахунків
будуть точні тільки до масової концентрації близько 15 %. За водного розчину
метанолу дані добре узгоджуються, оскільки цей розчин близький до
ідеального. Це пояснюється тим, що допущення, прийняті при складанні
рівняння, застосовні для водного розчину метанолу в досить широкому
діапазоні концентрацій.
Рисунок 3.2 – Температура замерзання водяних розчинів метанолу і етиленгліколю (ЕГ)
Як ще один приклад на рис. 3.3 показано криві температури замерзання
для розчинів хлориду натрію (кухонної солі). Легко бачити, що справжні
температури замерзання сольових розчинів розташовують на графіку значно
нижче, ніж розрахункові значення, обчислені на основі спрощеної теорії
зниження температури замерзання.
36