Page 135 - 4663
P. 135
енергетичного бар’єру. Наявність енергетичного бар’єру приводить до того,
що багато реакцій, які цілком можуть проходити самочинно, не
починаються. Наприклад, вугілля, деревина, нафта, які можуть горіти на
повітрі за звичайних умов не займаються. Це пов’язано з великою енергією
активації реакцій окиснення. Підвищення температури збільшує кількість
активних молекул, і тому дедалі більше молекул кисню, вугілля деревини та
нафти набувають необхідного запасу енергії для початку реакції. За певної
температури швидкість реакції досягає певної величини і починається
реакція горіння. Отже, під час хімічного процесу перехід системи вихідних
речовин з енергетичним станом Е вих у енергетичний стан продуктів реакції
Е пр здійснюється через енергетичний бар’єр, який дорівнює енергії активації
системи Е акт. При цьому тепловий ефект реакції Н=Е пр-Е вих (11.3)
(Н - тепловий ефект реакції, ентальпія системи). Позитивна величина
зміни ентальпії Н відповідає зменшенню ентальпії, або виділенню теплоти
системою.
Її визначають дослідним шляхом, часто позначають символом Е а та
виражають в кДж/моль. Так, наприклад, для реакції водню з йодом
H 2(г) + I 2(г) = 2HI(г), Е а = 167.4 кДж/моль.
Енергія активації Е а залежить від природи реагуючих речовин та
служить характеристикою кожної реакції.
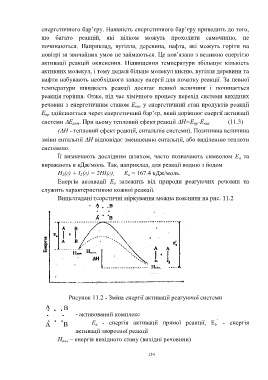
Вищезгадані теоретичні міркування можна пояснити на рис. 11.2
Н поч.
Нкін.
Рисунок 11.2 - Зміна енергії активації реагуючої системи
А В
- активований комплекс
’
А В Е а - енергія активації прямої реакції, Е а - енергія
активації зворотної реакції
Н поч – енергія вихідного стану (вихідні речовини)
134