Page 191 - 442
P. 191
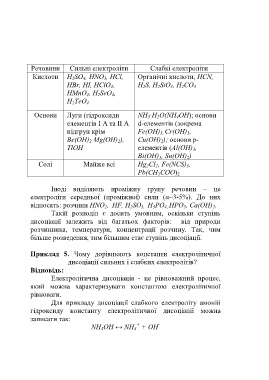
Речовини Сильні електроліти Слабкі електроліти
Кислоти H 2SO 4, HNO 3, HCl, Органічні кислоти, HCN,
HBr, HI, HClO 4, H 2S, H 2SiO 3, H 2CO 3
HMnO 4, H 2SeO 4,
H 2TeO 4
Основи Луги (гідроксиди NH 3∙H 2O(NH 4OH); основи
елементів І А та ІІ А d-елементів (зокрема
підгруп крім Fe(OH) 3, Cr(OH) 3,
Be(OH) 2 Mg(OH) 2), Cu(OH) 2); основи p-
TlOH елементів (Al(OH) 3,
Bi(OH) 3, Sn(OH) 2)
Солі Майже всі Hg 2Cl 2, Fe(NCS) 3,
Pb(CH 3COO) 2
Іноді виділяють проміжну групу речовин – це
електроліти середньої (проміжної) сили (α~3-5%). До них
відносять: розчини HNO 2, HF, H 2SО 3, H 3PO 4, НРО 3, Ca(OH) 2.
Такій розподіл є досить умовним, оскільки ступінь
дисоціації залежить від багатьох факторів: від природи
розчинника, температури, концентрації розчину. Так, чим
більше розведення, тим більшим стає ступінь дисоціації.
Приклад 5. Чому дорівнюють константи електролітичної
дисоціації сильних і слабких електролітів?
Відповідь:
Електролітична дисоціація - це рівноважний процес,
який можна характеризувати константою електролітичної
рівноваги.
Для прикладу дисоціації слабкого електроліту амоній
гідроксиду константу електролітичної дисоціації можна
записати так:
-
+
NH 4OH ↔ NH 4 + ОН