Page 25 - 4799
P. 25
Другу групу природних радіоактивних ізотопів утворюють
довгоіснуючі ізотопи, легші за свинець. Серед цих радіоактивних елементів
47
40
слід відмітити ізотопи калію ( K ), рубідію ( Rb ), індію ( 115 In ), самарію
( 147 Sm ), лютецію ( 179 Lu ), ренію ( 187 Re) і багато інших. Основні характеристики
деяких із цих ізотопів наведено в таблиці 3.1.
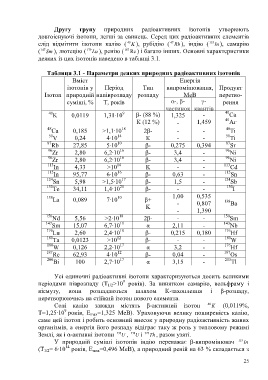
Таблиця 3.1 - Параметри деяких природних радіоактивних ізотопів
Вміст Енергія
ізотопів у Період Тип випромінювання, Продукт
Ізотоп природній напіврозпаду розпаду МеВ перетво-
суміші, % Т, років α-, β- γ- рення
частинок квантів
40 9 40
K 0,0119 1,31·10 β- (88 %) 1,325 - Са
К (12 %) - 1,459 40 Аг
48 18 48
Са 0,185 >1,1·10 2β- - - Тi
50 14 50
V 0,24 4·10 К - - Тi
87 10 87
Rb 27,85 5·10 β- 0,275 0,394 Sr
96 16 96
Zr 2,80 6,2·10 β- 3,4 - Ni
96 16 96
Zr 2,80 6,2·10 β- 3,4 - Ni
113 14 113
In 4,33 >10 K - - Сd
115 16 115
In 95,77 6·10 β- 0,63 - Sn
124 17 124
Sn 5,98 >1,5·10 β- 1,5 - Sb
130 21 130
Те 34,11 1,4·10 β- - - I
138 10 1,00 0,535
La 0,089 7·10 β+ - 0,807 138 Ва
K
- 1,390
150 18 150
Nd 5,56 >2·10 2β- - - Sm
147 11 143
Sm 15,07 6,7·10 α 2,11 - Nb
176 10 176
Lu 2,60 2,4·10 β- 0,215 0,180 Hf
180 12 180
Та 0,0123 >10 β- - - W
180 17 176
W 0,126 2,2·10 α 3,2 - Hf
187 12 187
Rе 62,93 4·10 β- 0,04 - Os
200 17 205
Bi 100 2,7·10 α 3,15 - Tl
Усі одиночні радіоактивні ізотопи характеризуються досить великими
9
періодами піврозпаду (Т 1/2>10 років). За винятком самарію, вольфраму і
вісмуту, вони розпадаються шляхом К-захоплення і β-розпаду,
перетворюючись на стійкий ізотоп нового елемента.
Солі калію завжди містять β-активний ізотоп 40 K (0,0119%,
9
Т=1,25·10 років, E max=1,325 МеВ). Ураховуючи велику поширеність калію,
саме цей ізотоп і робить основний внесок у природну радіоактивність живих
організмів, а енергія його розпаду відіграє таку ж роль у тепловому режимі
238
Землі, як і α-активні ізотопи 235 U , U і 323 Th , разом узяті.
У природній суміші ізотопів індію переважає β-випромінювач 115 In
14
(Т 1/2= 6·10 років, Е max=0,496 МеВ), а природний реній на 63 % складається з
25