Page 141 - 4663
P. 141
самій температурі можлива і зворотна реакція розкладу йодоводню. У
наведених прикладах реакцій можна визначити швидкості прямої та
зворотної реакції.
Однак, відомі також умови, за яких одночасно відбувається пряма та
зворотна реакції і в таких випадках визначити швидкість зворотної реакції
неможливо, а тому можна лише говорити про оборотність процесу.
Оборотні реакції не відбуваються до кінця, і закінчуються
встановленням хімічної рівноваги. Наприклад, у реакції синтезу аміаку
рівновага наступає тоді, коли в одиницю часу утворюється стільки ж
молекул аміаку, скільки їх розпадається на Нітроген та Гідроген.
Значить: хімічну рівновагу можна визначити як такий стан системи
реагуючих речовин, за якого швидкості прямої та оберненої реакції
рівні між собою. У цьому стані пряма та обернена реакції не зупиняються.
Така рівновага називається динамічною і в реагуючій суміші видимих змін
не проходить: концентрації всіх речовин - як вихідних, так і тих, які
утворюються, залишаються виключно постійними.
Концентрації реагуючих речовин, що встановлюються при
хімічній рівновазі називаються рівноважними. Вони позначаються
формулами реагуючих речовин, взятих у квадратні дужки, наприклад: [H 2],
[N 2], [NH 3], тоді як нерівноважні концентрації позначаються так:
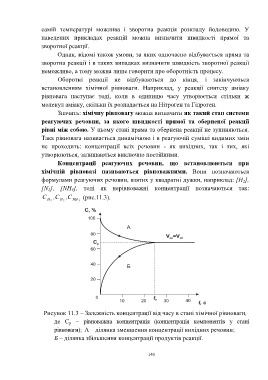
C H 2 C , N 2 C , NH 3 (рис.11.3).
Рисунок 11.3 – Залежність концентрації від часу в стані хімічної рівноваги,
де С р – рівноважна концентрація (концентрація компонентів у стані
рівноваги); A – ділянка зменшення концентрації вихідних речовин;
Б – ділянка збільшення концентрації продуктів реакції.
140