Page 13 - 6140
P. 13
речовини νЕ.
Молярна маса еквівалента (МЕ) – це маса одного
моля еквівалентів речовини. Вона дорівнює добутку
молярної маси речовини на фактор еквівалентності:
МЕ = М·fЕ.
Молярна маса еквівалента має розмірність «г/моль».
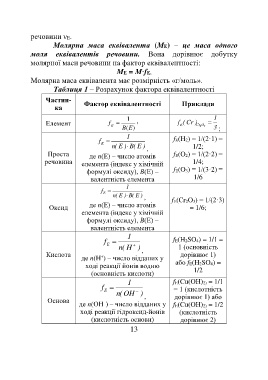
Таблиця 1 – Розрахунок фактора еквівалентності
Частин- Фактор еквівалентності Приклади
ка
1 1
Елемент f , f (Cr ) Cr O
E
E
В (E ) 2 3 3 ;
1
f fЕ(H2) = 1/(2·1) =
E
n( E ) B( E ) , 1/2;
Проста де n(Е) – число атомів fЕ(O2) = 1/(2·2) =
речовина елемента (індекс у хімічній 1/4;
формулі оксиду), В(Е) – fЕ(O3) = 1/(3·2) =
валентність елемента 1/6
1
f
E
n( E ) B( E ) , fЕ(Cr2O3) = 1/(2·3)
Оксид де n(Е) – число атомів = 1/6;
елемента (індекс у хімічній
формулі оксиду), В(Е) –
валентність елемента
1
f fЕ(H2SO4) = 1/1 =
E
n( H ) , 1 (основність
Кислота дорівнює 1)
+
де n(H ) – число відданих у
ході реакції йонів водню або fЕ(H2SO4) =
(основність кислоти) 1/2
1 fЕ(Cu(OH)2) = 1/1
f = 1 (кислотність
E
n(OH ) , дорівнює 1) або
Основа
–
де n(ОH ) – число відданих у fЕ(Cu(OH)2) = 1/2
ході реакції гідроксид-йонів (кислотність
(кислотність основи) дорівнює 2)
13