Page 43 - 4435
P. 43
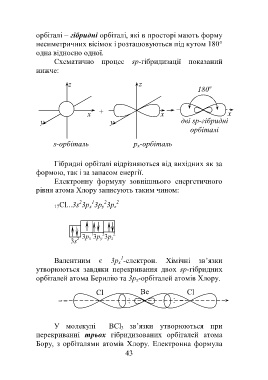
орбіталі – гібридні орбіталі, які в просторі мають форму
несиметричних вісімок і розташовуються під кутом 180°
одна відносно одної.
Схематично процес sp-гібридизації показаний
нижче:
z z о
180
x + x x
y y дві sp-гібридні
орбіталі
s-орбіталь p x-орбіталь
Гібридні орбіталі відрізняються від вихідних як за
формою, так і за запасом енергії.
Електронну формулу зовнішнього енергетичного
рівня атома Хлору записують таким чином:
2 1 2 2
17Cl...3s 3p x 3p y 3p z
2
1
2
2 3p х 3p y 3p z
3s
1
Валентним є 3p x -електрон. Хімічні зв’язки
утворюються завдяки перекривання двох sр-гібридних
орбіталей атома Берилію та 3р х-орбіталей атомів Хлору.
Cl Be Cl
∙ ∙
∙ ∙
У молекулі BСl 3 зв’язки утворюються при
перекриванні трьох гібридизованих орбіталей атома
Бору, з орбіталями атомів Хлору. Електронна формула
43