Page 52 - 6862
P. 52
1. У реформері, за високої температури (900 °С) відбувається реакція
речовини з водою. Для метану ця реакція є такою:
CH 4 + 2H 2O → 4H 2 + CO 2. (4.3)
Отриманий водень подають на вхід ПЕ.
2. У камері ПЕ, за підвищеної температури з додаванням особливих
каталізаторів.
Розробки в сфері ПЕ можуть бути використані для електроживлення
мобільних і портативних пристроїв і автономного тепло- і електрозабезпечення
будинків. Вихідна потужність ПЕ може змінюватись у широких межах зі
збереженням високих значень ККД. Використання паливних елементів стримує
їх висока вартість (приблизно 4 000 $ на 1 кВт потужності). Типи ПЕ для
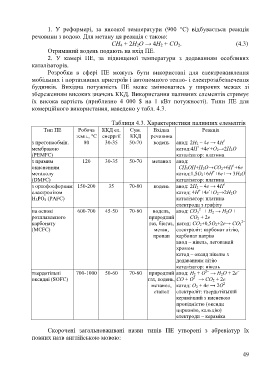
комерційного використання, наведено у табл. 4.3.
Таблиця 4.3. Характеристики паливних елементів
Тип ПЕ Робоча ККД ел. Сум. Вхідна Реакція
темп., °С енерргії ККД речовина
+
з протонообмін. 80 30-35 50-70 водень анод: 2H 2 – 4e → 4H
-
+
мембраною катод:4Н +4е +О 2→2Н 2О
(PEMFC) каталізатор: платина
з прямим 120 30-35 50-70 метанол анод:
+
окисненням СH 3ОН+Н 2О→СО 2+6H +6е
+
метанолу катод:1,5О 2+6Н +6е+→ 3Н 2О
(DMFC) каталізатор: платина
+
з ортофосфорним 150-200 35 70-80 водень анод: 2H 2 – 4e → 4H
+
-
електролітом катод: 4Н +4е +О 2→2Н 2О
Н 3РО 4 (PAFC) каталізатор: платина
електроди з графіту
2–
на основі 600-700 45-50 70-80 водень, анод: CO 3 + H 2 → H 2O +
розплавленого природний CO 2 + 2e
2–
карбонату газ, біогаз, катод: CO 2+0,5O 2+2e→ CO 3
(MCFC) метан, електроліт: карбонат літію,
пропан карбонат натрію
анод – нікель, легований
хромом
катод – оксид нікелю з
додаванням літію
каталізатор: нікель
2–
–
твердотільні 700-1000 50-60 70-80 природний анод: H 2 + O → H 2O + 2e
–
2–
оксидні (SOFC) газ, водень, CO + O → CO 2 + 2e
2–
метанол, катод: O 2 + 4e → 2O
етанол електроліт: твердотільний
керамічний з кисневою
провідністю (оксиди
цирконію, кальцію)
електроди – кераміка
Скорочені загальновживані назви типів ПЕ утворені з абревіатур їх
повних назв англійською мовою:
49